新版《药品技术转让注册管理规定》核心解读 推动产业升级与技术流动

为深化药品审评审批制度改革,进一步激发医药产业创新活力,国家药品监督管理部门对药品技术转让的相关规定进行了重要修订与完善。新版《药品技术转让注册管理规定》(以下简称《规定》)的出台,标志着我国药品技术转让管理迈入更加科学、规范和高效的新阶段。本文旨在对其核心内容与精神进行解读。
一、 明确转让范围与分类,强化全生命周期管理
新版《规定》系统性地界定了药品技术转让的范围,不仅包括传统的药品批准文号所有权的转移,更将药品生产技术、质量控制方法、相关知识产权等无形资产的整体或部分转移纳入规范。尤为重要的是,它强调了药品全生命周期的技术管理理念,要求转让必须确保药品在生命周期内的质量、安全性和有效性的持续可控。这促使转让双方从研发、生产到上市后监测等环节进行全方位对接与责任明确,有效避免了因技术衔接不畅导致的质量风险。
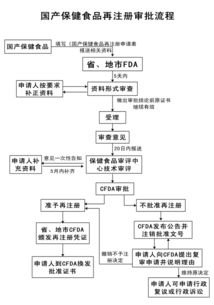
二、 优化审评审批流程,提升转让效率
效率是技术流动的关键。新版《规定》显著优化了审评审批程序,对符合特定条件的转让申请(如不改变药品生产场地、生产工艺和质量标准等核心要素的转让)设置了简化的审评路径,缩短了审批时限。明确了申报资料要求,提高了资料提交的规范性与透明度,减少了因资料不全或不符导致的反复补充,从而加快了技术成果产业化的速度,有助于优势技术资源尽快服务于临床和市场。
三、 厘清主体责任,保障药品质量安全
质量安全是药品的底线。新版《规定》进一步厘清了转让方与受让方的法律责任与义务。转让方必须确保所转让技术的真实性、完整性和可实施性,并对转让前产品的质量历史负责;受让方则必须完全具备实施该技术的硬件条件、质量管理体系和专业技术能力,并对转让后产品的生产与质量承担全部主体责任。这种责任界定强化了技术转让过程中的风险控制,确保药品在“易主”过程中质量不降、标准不松。
四、 鼓励创新与资源整合,服务产业高质量发展
新规的导向十分明确:鼓励真正有价值的创新技术和临床急需品种的技术流动。它为研发机构、创新型中小企业将早期研发成果向具备产业化能力的企业转让提供了更清晰的路径,促进了产学研深度融合。也利于大型企业通过技术转让整合优势产品线,优化资源配置,淘汰落后产能,从而推动整个医药产业的结构调整与转型升级,提升核心竞争力。
五、 加强监督管理与信息公开,构建诚信体系
新版《规定》配套了更为严格的监督措施。药品监督管理部门将加强对技术转让批准后产品的上市后监管和GMP符合性检查。大力推进技术转让相关信息的公开,接受社会监督。这有助于建立医药技术领域的诚信体系,对弄虚作假、不负责任的技术转让行为形成有力震慑,营造公平、透明、健康的技术交易环境。
****
新版《药品技术转让注册管理规定》立足于我国医药产业发展现状与监管需求,以保障公众用药安全有效为根本,以激发产业创新活力为目标,通过制度的优化与责任的压实,为药品技术的合理、有序、高效流动铺平了道路。它的实施,预计将加速行业内的优胜劣汰与资源重组,促进新技术、好品种更快惠及患者,是我国从制药大国迈向制药强国进程中的一项重要制度支撑。相关药品研发机构、生产企业应深入学习理解新规要求,主动适应变化,在合规框架下积极利用技术转让政策,实现自身发展与产业进步的双赢。
如若转载,请注明出处:http://www.ijsdaas.com/product/55.html
更新时间:2026-01-12 11:10:16